在新冠疫情持续,国内外多国多地散点式爆发下;创新药物研发从未停歇!
转眼,2022年进入最后一个季度。据公开资料不完全统计,2022年第四季度将有15款新药获FDA首批上市,包括5款单抗、4款化药、2款双抗、1款ADC疗法、1款基因疗法、1款微生物疗法和1款组合疗法。适应症涉及肿瘤领域、罕见病以及常见慢性疾病等多个治疗领域。
2022年第四季度有望在美国获批的新药
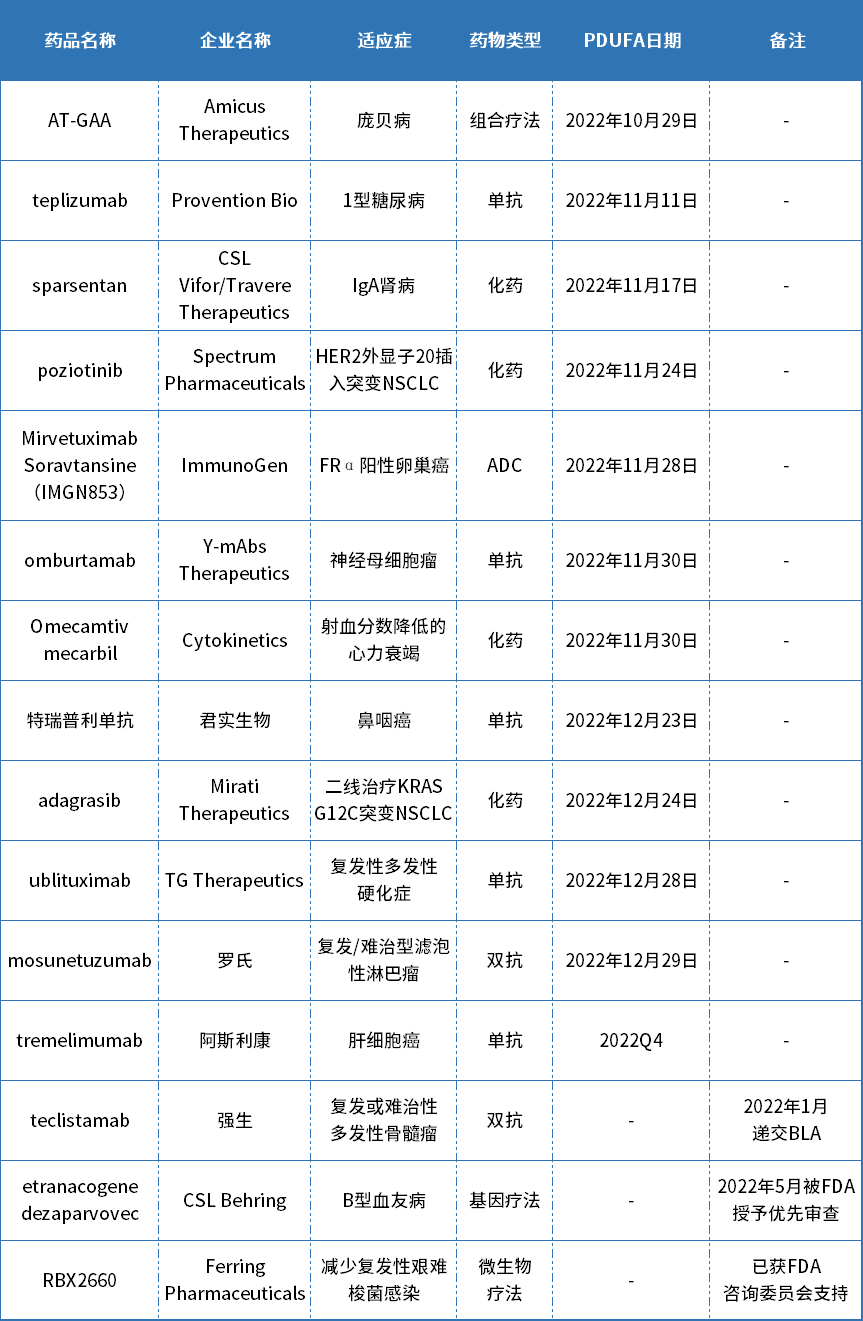
资料来源:公开资料(不完全统计)
9款“首个”新疗法即将面世
值得注意的是,15款即将获FDA批准的创新药,有9个为即将“首批”的“新疗法”。
分别为强生的teclistamab,事实上2022年8月EMA有条件批准该药作为单一疗法用于治疗复发或难治性多发性骨髓瘤成人患者上市,这是teclistamab在全球范围内的首个批准上市;为全球获批的首款BCMA/CD3靶向双抗;2021年1月和6月,欧盟EMA和美国FDA分别授予了teclistamab优先药物资格(PRIME)和突破性药物资格(BTD),2022年1月强生向美国食品和药物管理局(FDA)提交了teclistamab(JNJ-64007957,JNJ-7957)的生物制品许可申请(BLA),用于治疗复发或难治性(R/R)多发性骨髓瘤(MM);不出意外,预计将在Q4获FDA批准上市。
此外,君实生物的特瑞普利单抗有望成为美国首个且唯一用于鼻咽癌治疗的肿瘤免疫药物;
罗氏的mosunetuzumab是全球批准的首款CD20/CD3靶向双抗,2022年6月被EMA批准用于治疗复发性/难治性滤泡性淋巴瘤;
ImmunoGen公司的MirvetuximabSoravtansine(IMGN853)有望成为全球首个针对叶酸受体α(FRα)阳性卵巢癌的ADC疗法;
CSLBehring的etranacogenedezaparvovec有望成为首个治疗B型血友病的基因疗法;
FerringPharmaceuticals的RBX2660有望成为首个获批的微生物组疗法;
TravereTherapeutics的sparsentan有望成为FDA批准治疗IgA肾病的首个非免疫抑制疗法;
ProventionBio的teplizumab有望成为第一种可预防/延缓高危人群发展为临床1型糖尿病(T1D)的疗法;
Y-mAbsTherapeutics的omburtamab有潜力成为FDA批准的首个针对中枢神经系统(CNS)/软脑膜转移的神经母细胞瘤儿童患者的靶向疗法,且有望成为FDA批准的首款B7-H3靶向疗法。
打破单品独占
这三款新药将成搅局者
另从作用靶点和药物类型来看,阿斯利康的tremelimumab、MiratiTherapeutics的adagrasib及SpectrumPharmaceuticals的poziotinib将分别打破已有同类上市药物的独占市场格局,瓜分相应治疗领域的市场蛋糕。
其中,阿斯利康的tremelimumab有望成为继Yervoy(BMS)之后,全球批准的第二款获批的CTLA-4抗体。tremelimumab在经历18年的研发,经过一波三折的命运后;辗转于辉瑞、阿斯利康之间,尝试过多个不同癌种的适应症开发方向后,终于迎来胜利的曙光。
据悉,自Yervoy获得FDA获得批准上市以来,一直位列全球抗肿瘤畅销药之列,2021销售额为20.2亿美元,同比增长20%。不过近年来,随着抗体药物的不断增多,Yervoy业绩增速乏力,如今tremelimumab若顺利获批,将进一步加剧Yervoy销售的低迷之况。
Yervoy历年销售情况
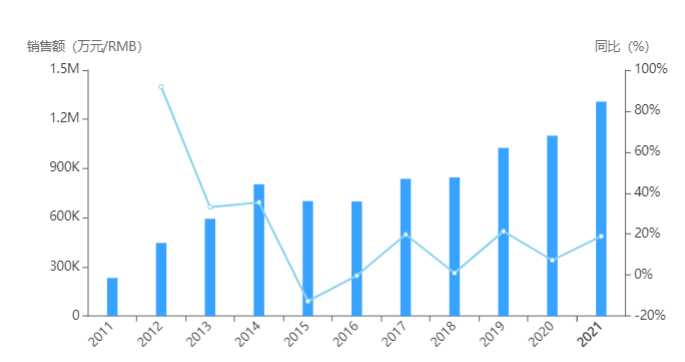
图片来源:药智数据全球畅销药数据库
MiratiTherapeutics的adagrasib有望成为继Sotorasib(安进)之后第二款获批的KRASG12C抑制剂。众所周知,KRAS曾被认为是“不可成药”靶点,目前全球仅安进的Sotorasib已上市,且上市时间还未到一年;如若2022年12月14日之前,MiratiTherapeutics的adagrasib顺利获批上市,直接将对Sotorasib发起挑战,KRASG12C抑制剂领域市场鹿死谁手还未可知。
目前全球布局进行KRAS靶点研究的企业有劲方医药、贝达药业、璎黎药业、安进、益方生物、MiratiTherapeutics、杨森、健艾仕、诺华、勃林格殷格翰、礼来等企业。
poziotinib有望成为继T-DXd(第一三共)之后第二款获批治疗HER2突变NSCLC治疗药物。今年8月11日,FDA批准Enhertu用于HER2突变非小细胞肺癌二线治疗,成为全球首个获批用于HER2突变NSCLC药物;HER2基因变异NSCLC靶向治疗当前的挑战和未来发展方向,poziotinib的若获批,又将是抗NSCLC治疗药物的一大突破。
多款延期新药,Q4能否如期上市?
不过,令人担忧的是,多款药物按照原定计划,今年应该是早早获批上市,但由于新冠疫情及其他因素,被延迟上市,能否在第四季度如期被批准,值得期待。
特瑞普利单抗是一款PD-1单抗,最早于2021年3月向FDA滚动递交单抗治疗复发或转移性鼻咽癌的BLA,但由于新型冠状病毒肺炎(COVID-19)疫情相关的旅行限制阻碍了FDA前来完成必要的现场核查工作。今年7月6日,君实生物重新向FDA提交的特瑞普利单抗联合吉西他滨/顺铂作为晚期复发或转移性鼻咽癌(NPC)患者的一线治疗和单药用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗的生物制品许可申请(BLA),PDUFA定为2022年12月23日。
实际上,特瑞普利单抗注射液作为我国批准上市的首个国产以PD-1为靶点的单抗药物;已在中国获批5项适应症;2020年12月,特瑞普利单抗首次通过国家医保谈判,目前已有3项适应症纳入《2021年药品目录》,是国家医保目录中唯一用于治疗黑色素瘤和鼻咽癌的抗PD-1单抗药物。如若顺利获批,也是国产生物类似药成功出海的一大标志。
AT-GAA是一种双组分疗法,由cipaglucosidasealfa和麦格司他组成。在临床前研究中,AT-GAA与成熟溶酶体形式的GAA水平升高和肌肉中糖原水平降低、自噬缺陷缓解和肌肉力量改善有关。今年5月,公司宣布FDA将AT-GAA的PDUFA日期延长至2022年10年29。
ublituximab是一种新型糖工程化抗CD20单克隆抗体,靶向成熟B淋巴细胞上CD20抗原的独特表位,其表位与已获批的CD20单抗不同,包括ofatumumab、ocrelizumab/rituximab、obinutuzumab(GA101)。据悉,ublituximab治疗复发型多发性硬化(RMS)的疗效优于重磅多发性硬化药物Aubagio(特立氟胺)。5月31日,TGTherapeutics宣布FDA将ublituximab治疗复RMS的BLA的PDUFA日期延长至2022年12月28日。
teplizumab是一种抗CD3单克隆抗体,适用于体内存在2种或多种与1型糖尿病相关的自身抗体的高危人群,用来预防或延缓T1D。6月30日,ProventionBio宣布FDA将teplizumab的PDUFA延长至2022年11月17日。
参考资料:
1.阿斯利康:难产十八年,CTLA-4单抗Tremelimumab终于获FDA优先审查靶点社
2.企业公告等公开资料信息

